主役は遅れてやってくる?(Vilinus大学のCRISPR-Cas9システムのJP特許成立)
Broad v UCBの主導権争いに関しては、半分(sgRNA)について大まかに情勢が固まり、後は残り半分(二本鎖)の主導権を誰が握るのかが焦点となります。
二本鎖型の特許を取得する上での問題点は、古細菌に同様のシステムがあるため、文言で差別化してくのが難しい点です。この点、Broadは、USにおいて上手く特許を取得した形になります。
さて、基本特許の取得において、BroadとUCBとが熾烈な争いを行っており影が薄いですが、Vilinus大学が二本鎖型と関連するCRISPR-Cas9システムに関する最先の出願を行っており、今のところ特許戦略がしょぼくて微妙な状況ですが、二本鎖型についてはダークホース的な存在です。
最先の出願人がダークホースという点がおかしいという点はおいておく。
そんな、VilinusのJPの特許出願(特願2015-501880)について9月18日付けで特許査定が送達され、ついに成立しそうです。
VilinusのJP特許の主なクレームは、
・in vitroにおいて標的DNA分子を部位特異的に修飾するための方法(請求項1)
・プログラム可能なCas9-crRNA複合体(請求項15)
から構成されます。
さて、もう少し詳しく見ていきましょう。まずは、方法の発明。
【請求項1】
in vitroにおいて標的DNA分子を部位特異的に修飾するための方法であって、
in vitroでCas9タンパク質、crRNAおよびtracrRNAを組み合わせること、および、
標的DNA分子を、前記Cas9タンパク質、前記crRNAおよび前記tracrRNAから形成された設計されたCas9-crRNA複合体と接触させることを含み、
crRNAが、Cas9-crRNA複合体を標的DNA分子中の前記部位を含む領域に誘導するように設計される、方法。
請求項1の方法は、in vitroでCas9タンパク質、crRNAおよびtracrRNAの複合体を形成させ、これをターゲットの配列を含む核酸分子と接触させ、ターゲットを修飾する方法となります。
請求項1における「in vitro」の解釈ですが、2018年4月24日付けの拒絶理由通知に対する応答を考慮すると、文字通り試験管内での利用となり、細胞内(in vivo)での利用は含みませんし、当然に、ex vivoも含みません。
また、「修飾」に関して明細書に明確な定義はありませんが、明細書全文から解釈すると二本鎖の分解ないしニックの導入と解釈できます。
したがって、方法クレームは、無細胞系において、二本鎖型のCRISPR-Cas9複合体を形成し、得られた複合体を引き続き無細胞系においてターゲットの配列を含む核酸分子と接触させ、ターゲットの配列において、二本鎖の切断ないしニックの導入を行う方法と解釈できます。
あれ、使えない特許…
つぎに物の発明。
【請求項15】
プログラム可能なCas9-crRNA複合体であって、以下:
Cas9タンパク質、
3’および5’領域を含む合成されたcrRNAポリヌクレオチドであって、3’領域がCRISPR 遺伝子座中に存在するリピート配列を含み、5’領域がCRISPR遺伝子座中のリピートの下 流の設計されたスペーサー配列の少なくとも20ヌクレオチドを含むcrRNAポリヌクレオチド、および
5’および3’領域を含む合成されたtracrRNAポリヌクレオチドを含み、
ここで、プログラム可能なCas9-crRNA複合体はin vitroで組み立てられ、かつ、 前記スペーサー配列は、Cas9-crRNA複合体がプロトスペーサー隣接モチーフ配列を有する標的DNA分子を指向するように設計されている、Cas9-crRNA複合体。
請求項1と基本的には同様に解釈できますが、組み立てがin vitroで行われればよく、その後の使用環境は特に制限されていません。
このため、in vitroで形成されたCRISPR-Cas9複合体を細胞内(in vivo)等で使用する場合は、請求項15に引っかかることとなります。この点が、方法のクレームとは異なってきます。
具体例として、組成物の成分として複合体を予め作製しておき、これを、リポフェクション、エレクトロポレーション等で細胞等に導入する場合があげられます。
試薬販売業者等の製造者がコンポーネントをばらして準備して販売したとしても、mixtureにした段階で一部は複合体が形成されます。このため、CRISPR-Cas9システムの使用者にとってはやっかいになりそうです。
ただし、ベクターにコンポーネントをのっけて細胞に導入すれば回避できるため、回避は容易です。
したがって、何らかの事情があって、複合体を形成後に導入しないといけない場合をのぞき、あまり影響はないと考えられます。
(プログラム可能という記載の意味が分かりにくいですが、明細書全体から解釈すると、要はターゲットに併せて設計を変更可能なという意味合いになります。)
ということで、今回のVilinusの特許は、二本鎖型のCRISPR-Cas9システムの特許としてはあまり気にするほどのものではなさそうです。
CRISPR-CAS9特許を巡る憂鬱
数日前に、下記Broad特許群と、下記UC Berkeley(UCB)特許とのインターフェアレンスに関する審決取消訴訟において、やっとこさCAFCの判決がでました。
Broad特許群
・Patents
8,697,359; 8,771,945; 8,795,965; 8,865,406; 8,871,445; 8,889,356; 8,895,308; 8,906,616; 8,932,814; 8,945,839; 8,993,233; 8,999,641
・Application
14/704,551
UCB特許
・Application
13/842,859
結果は、UCBの請求棄却となり、PTABの両特許の抵触は無しとの判断に誤りはないということなります。
UCBは最高裁への上告を検討するとプレスリリースしていますが、最高裁の受理率および本件の争点を考えると受理され、かつ判決がひっくり返る確率は可能性はかなり低そうです。
なお、US特許弁護士によると、本件についてはそもそも審決取消を求めてもひっくり返る可能性が低い事件であったとのことでした。
基本特許が1件か、2件かで、UCBの特許の価値は雲泥の差になるため、見通しはよくなくてもチャレンジすること自体は至って妥当ですが。
さて、今後の流れは、大まかにまとめると以下のようになります。
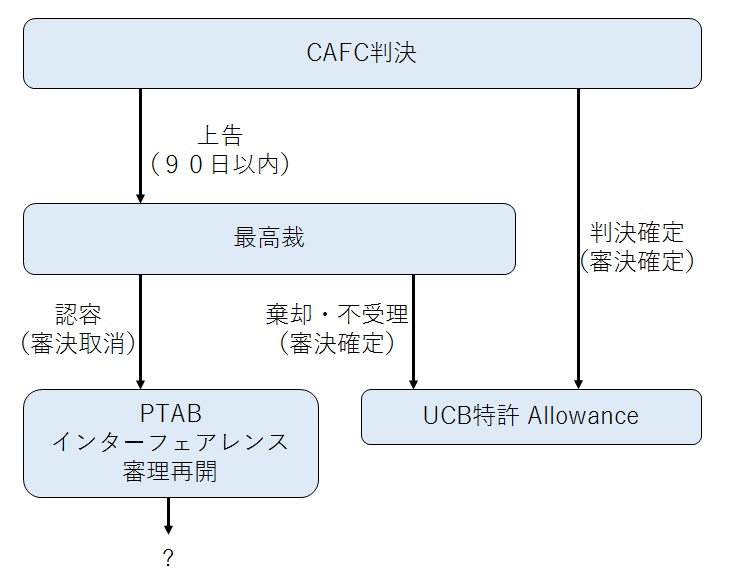
最高裁に受理されPTABの判断が覆された場合、PTABで審理が再開されます。この場合、PATBの両特許が抵触しないとの判断が取り消されるため、両特許は抵触しているものとして、どちらが先に発明されたかを争うことになります。
結果はどうなるか不明です。
他方、上告しない場合、または上告したものの棄却もしくは不受理の場合、PATBの審決が確定し、両特許は抵触しないとの判断が確定します。
この場合、UCB特許については、他の拒絶理由が既に解消しているため、最後に提出したClaimでAllowanceされ、Broadの基本特許と、UCBの基本特許とが並立します。
後者となった場合、以下の特許が並立することになります。全メインクレームの比較は面倒なので、1つ目の請求項のみですが、お許しください。
・Broad (US 8,697,359 B、下線は強調のため付加)
- A method of altering expression of at least one gene product comprising
introducing into a eukaryotic cell containing and expressing a DNA molecule having a target sequence and encoding the gene product an engineered, non-naturally occurring Clustered Regularly Interspaced Short Palindromic Repeats (CRISPR)—CRISPR associated (Cas) (CRISPR-Cas) system comprising one or more vectors comprising:
- a) a first regulatory element operable in a eukaryotic cell operably linked to at least one nucleotide sequence encoding a CRISPR-Cas system guide RNA that hybridizes with the target sequence, and
- b) a second regulatory element operable in a eukaryotic cell operably linked to a nucleotide sequence encoding a Type-II Cas9 protein,
wherein components (a) and (b) are located on same or different vectors of the system, whereby the guide RNA targets the target sequence and the Cas9 protein cleaves the DNA molecule, whereby expression of the at least one gene product is altered; and, wherein the Cas9 protein and the guide RNA do not naturally occur together.
・UCB (13/842,859、下線は強調のため付加)
- A method of cleaving a nucleic acid comprising
contacting a target DNA having target sequence with an engineered and/or non-naturally occurring Type II Clustered Regulatory Interspaced Short Palindromic Repeats (CRISPR) – CRISPR associated (Cas) (CRISPR-Cas) system comprising
a) a Cas9 protein; and
b) a single molecule DNA-targeting RNA comprising
i) a targeter-RNA that hybridizes with the target sequence, and
ii) an activator-RNA that hybridizes with targeter-RNA to form double-stranded RNA duplex of a protein-binding segment,
wherein the activator-RNA and the targeter-RNA are covalently linked to one another with intervening nucleotides,
wherein the single molecule DNA-targeting RNA form a complex with the Cas9 Protein,
whereby the single molecule DNA-targeting RNA targets the target sequence, and the Cas9 protein cleaves the target DNA molecule.
さて、どちらが広いかというと一長一短(主に下線部)があるため、詳細は割愛します。
導入するターゲットのみに注目した場合、Broadは、ターゲットが真核細胞(a eukaryotic cell)に限定されるのに対し、UCBは、ターゲットの限定がなく、ターゲットとして真核生物、原核生物および無細胞系のいずれも含むことになります。
UCBの特許はsgRNAの形態に限定されているため(上記b)の部分)、sgRNAを用いるCRISPR-CAS9システムでは、BroadおよびUCBの両者からのライセンスが必要になります。
CRISPR-CAS9システムの実用化において、農業用途に関しては、Dupont Pioneerに特許群のライセンスが集約されつつあり、かつ一括ライセンスする旨を公表しているため、利用しやすい状況になりそうな情勢です。
他方、農業以外の用途では未だにライセンスの集約には至っていません。
特に、医薬用途に関しては製品をカバーする特許群を一人の権利者が握ることにより、初めて莫大な利益を得ることができます。このため、上記のように基本特許が複数の権利者によりばらばらに保有される状況が生じるとライセンス交渉が複雑化し、活用に黄色信号が灯る可能性もあります。
もしかしたらsiRNA特許群の時のアルナイラムのように、どこかが全部を買い取るか?
CRISPR Therapeuticsが治験を開始するため、今後絡まった権利関係をどのように解していくのかは、実用化を考えていく上で注視する必要があります。
免疫チェックポイント阻害薬の特許の状況(余談)
昨日の投稿の続き。
抗PD-L1抗体の作用機序に関して、テセントリクのみはっていたので、残り二つについても時間のある間に調べてみました。
バベンチオの作用機序については、HPによると以下のような記載があります。

「バベンチオ®は、腫瘍細胞上のPD-L1とT細胞上のPD-1の結合を阻害することで、活性型T細胞における抑制的調節を遮断します。その結果、腫瘍抗原特異的に働くT細胞が増殖、活性化することにより、腫瘍の増殖を抑制すると考えられています。バベンチオ®は主に、抗腫瘍CD8+細胞傷害性T細胞による免疫応答を増強します。」
また、イミフィンジの作用機序については、HPによると以下のような記載があります。

「イミフィンジ®は、切除不能な局所進行(ステージIII)非小細胞肺がんに対する治療薬として承認された、本邦初の抗PD-L1ヒトモノクローナル抗体(抗PD-L1抗体)です。PD-L1に結合し、PD-L1とその受容体であるPD-1との結合を阻害すること等により、抗腫瘍免疫応答を増強し、腫瘍増殖を抑制すると考えられています。特に、腫瘍量を減少させ、がん抗原特異的なT細胞の細胞傷害活性を誘導させる放射線治療の後にイミフィンジ®を用いることで、より効率的に抗腫瘍免疫応答を回復し、がんの排除を促すことが期待できます。」
このため、HP上の記載に基づけば、バベンチオについては「PD-1の免疫抑制シグナルを抑制する」ことを示唆する記載はありますが、バベンチオおよびイミフィンジについても、テセントリクと同様に、第3および第5世代のクレームに記載されているように、抗PD-L1抗体が「PD-1の免疫抑制シグナルを抑制する」かは不明です。
ということで、抗PD-L1抗体に関しては、「PD-1の免疫抑制シグナルを抑制する」という文言の充足性が争いとなっていそうです。
さらなる余談。
小野薬はもめそうな文言をなぜ入れたのか?
出願経過での対応で導入せざる得なかった可能性もあるため、第3世代の出願の包袋を確認してみました。
出願当初は下記の通りであり、別の性質でがん治療薬を特定するクレームとなっています。
【請求項1】
抗PD-L1抗体を有効成分として含み、インビボにおいて癌細胞の増殖を抑制する作 用を有する癌治療剤。
このクレームであれば、各社のがん治療薬は、結果的にインビボにおいてがん細胞の増殖を結果的に抑制しているため、充足しているようにも読めます。
が、審査請求後、最初の拒絶理由通知前に、登録時のクレームと同一文言に補正しており、抗体の性質を特定する文言は、出願経過での対応とは関係なく導入されているようです。
ということで、なんらかの意図をもって補正をしているようで。
他の可能性を考慮しての対応ということになるが、何なのか…。
サポート要件違反等の記載要件違反を指摘されることを避けるため…?
出願時のクレームの場合、「本願明細書および技術常識に基づいても、あらゆる抗PD-L1抗体がin vivoでがん細胞の増殖を抑制できるとはいえない」、「PD-1とPD-L1との相互作用を阻害できない抗PD-L1抗体について、本願明細書および技術常識に基づいても、抗PD-L1抗体がin vivoでがん細胞の増殖を抑制できるとはいえない」としてサポート要件違反を指摘される可能性を考慮した可能性はあります。
ただ、補正等により対応可能なため、理由としては弱い気も。
真相は小野薬の方しか分からなさそうです。
上記2点に関しては、クレームの文言をうまく調整してやることにより、両者とも回避可能です。
一例として、本発明では、がん治療薬はPD-1 -PD-L1の相互作用を阻害することにより、抗がん作用を示すため、下記のようなクレームの方がベターだったのではないかと考えます。
まあ、結果をみての作文なので、なんとでも書けるのですが…
PD-1と、PD-L1との相互作用を阻害する抗PD-L1抗体を含むことを特徴とする、がん治療薬。
免疫チェックポイント阻害薬の特許の状況
CRISPR-CAS9の話を書いていましたが、たまには別のネタ。
小野薬品工業のオプジーボの上市後、PD-1 - PD-L1の相互作用をターゲットとする新薬が次々と開発及び上市されています。
上市済みのものは以下のとおり。
・抗PD-1抗体
キイトルーダ(MSD)
・抗PD-L1抗体
テセントリク(Roche、中外、Genentech)
バベンチオ(メルクセローノ、ファイザー)
イミフィンジ(アストラゼネカ)
さて、PD-1 - PD-L1の相互作用を阻害することでがんを治療できるという概念は、京大の本庶先生らが見出した発明です。
そして、これに関する特許出願(PCT/JP2003/008420、特願2004-519238、以下、ファミリー出願をまとめて本庶特許という)は、本庶先生と小野薬との共願で出願されています。
なお、本庶先生の持ち分は職務発明として京大に承継の打診があったのですが、先見の明がない京大が断ったのは有名な話…
MSDのキイトルーダについては、本庶特許との関係で小野薬ともめ、各国で無効性、侵害の有無等を争った後に和解に至っています。
https://www.ono.co.jp/jpnw/PDF/n17_0121.pdf
他方、抗PD-L1抗体については、そのような話は現状プレスリリースされていません。
あれっ、小野薬って抗PD-L1抗体を有効成分として含むがん治療薬の特許を取り損ねていたっけ…?ということで、日本について本庶特許をあさってみました。
日本において、本庶特許は既に6回の分割を重ねて、第6世代までいっております…。各世代の願番、特許番号及びメインクレームは以下のとおり。
・親出願(特願2004-519238、特許第4409430号)
PD-1抗体を有効成分として含み、インビボにおいてメラノーマの増殖または転移を抑制する作用を有するメラノーマ治療剤。
・第1世代(特願2009-203514、特許第5159730号、子出願)
PD-1抗体を有効成分として含み、インビボにおいて癌細胞の増殖を抑制する作用を有する癌治療剤(但し、メラノーマ治療剤を除く。)。
・第2世代(特願 2012-197861、特許第5701266号、孫出願)
抗PD-1抗体を有効成分として含む、ウイルス性肝炎治療剤。
・第3世代(特願2014-007941、特許第5885764号、ひ孫出願)
PD-1の免疫抑制シグナルを阻害する抗PD-L1抗体を有効成分として含む癌治療剤。
・第4世代(特願2015-095990、特許第6035372号、玄孫出願)
PD-1の免疫抑制シグナルを阻害する、キメラ、ヒト化または完全ヒト型抗PD-1抗体を有効成分として含む肺癌治療剤。
・第5世代(特願 2016-184782、特許第6258428号、来孫出願)
PD-1の免疫抑制シグナルを阻害する抗PD-L1抗体を有効成分として含む、癌治療用の静脈投与用注射剤。
・第6世代(特願2017-219349、昆孫出願)
遺伝子改変によりPD-1発現が阻害されたリンパ球細胞を有効成分として含む癌治療剤。
抗PD-1抗体を有効成分として含むがん治療薬は、親、第1および第4世代の特許によりカバーされていそうです。
他方、抗PD-L1抗体を有効成分として含むがん治療薬をカバーする特許としては、第3および第5世代の特許が該当しそうです。
さて、第3および第5世代の特許で抗PD-L1抗体を有効成分とする各社のがん治療薬はカバーされているのでしょうか。
一例として、中外製薬のテセントリクのHPを見ると、作用機序として以下のような記載があります。

テセントリクは、プライミングフェイズでは、B7-1とCD28との相互作用を促進することにより、エフェクターフェイズでは、PD-L1 - PD-1経路、PD-L1 - B7-1経路を阻害することにより、抗がん作用を示すようです。
このため、HP上の記載に基づけば、第3および第5世代のクレームに記載されているように、抗PD-L1抗体が「PD-1の免疫抑制シグナルを抑制する」かは不明です。
現状、本件特許について、各社がライセンスを受けたとのプレスがないのは、抗PD-L1抗体の機能に関する文言の充足性が争いとなっていることによる可能性がありそうです。
各社の上市後だいぶ時間がたってきているので、そろそろ、ライセンスなり、訴訟なりで表に出てくる頃でしょうか。
中外は侵害訴訟で最近連戦連勝なので、突っぱねそうな気もします。
CRISPR-CAS9システムの米国特許の成立
忙しい、と経過監視を怠っていると、色々と進むものです。
業務ではなく、あくまで趣味の一環です。
sgRNAを用いるCRISPR-CAS9システムの基本特許が日本で成立したとの話を前回投稿しましたが、3日後にUCBの米国特許が成立していました。
公報へのリンクが貼れないので、出願番号と、特許公報の番号を示します。
Application Number:14/685,502
Patent Number:10,000,772
公報番号の桁が一つ増えてる?!
米国において、UCBの基本特許はInterference→CAFCとBroadと絶賛係争中のため、特許が成立していませんでした。
Interferenceの開始後、UCBは、(おそらく)ライセンス関係のため、そして、特許ポートフォリオの充実を目的として多数の分割出願を始めていましたが、やっとこさ物になったようです。
さて、本件特許のメインクレームですが、下記の通りです。
- A method of modifying a target DNA molecule, the method comprising:
contacting a target DNA molecule having a target sequence with a complex comprising:
(a) a Cas9 protein; and
(b) a DNA-targeting RNA comprising:
(i) a targeter-RNA that hybridizes with the target sequence, and
(ii) an activator-RNA that hybridizes with the targeter-RNA to form a double-stranded RNA (dsRNA) duplex of a protein-binding segment,
wherein the activator-RNA hybridizes with the targeter-RNA to form a total of 10 to 15 base pairs,
wherein said contacting takes place outside of a bacterial cell and outside of an archaeal cell, thereby resulting in modification of the target DNA molecule.
大まかには、CAS9タンパク質とsgRNAとをターゲットDNAに接触させることでターゲットDNAを修飾する方法です。
本件の特徴的な構成はsgRNAの構成であり、具体的には、targeter-RNA (crRNA)とactivator RNA (tracrRNA)とがハイブリダイズする長さを規定している点です。
クレームでは10-15塩基長となっていますので、一般的にはこの範囲に含まれるのでしょう。
逆に、この範囲を外しても効果的にゲノム編集ができるのであれば、簡単に回避できることになります。
本件特許は物クレームではなく、方法クレームのため、試薬、キット、医薬品等の物を販売する場合には直接侵害にはなりません。
ただし、間接侵害(寄与侵害)が問題になるため、実質的にはこれらの物の販売行為には制限がかかることになります。
米国で事業を考えている方はご注意ください。
CRISPR-CAS9の基本特許の取得を争っている、二大巨頭の特許が米国で成立したので、そろそろ、侵害関係の係争が始まるかな?
CRISPR-CAS9システムの基本特許の成立(日本)
Broadの特許の成立後、Feng Zhangが来日して大合議体かいなというような審査官面接が行われたりしていましたが、審査が遅遅として進まない日本…。
しかし、ついにCRISPR-CAS9基本特許が成立しました。
特許公報確認!よかった
今回は、基本特許争いで、一番の有力候補であるUC Berkeley(UCB)の特許です。
特許第6343605号
特許・実用新案照会(固定アドレス)(結果一覧)|J-PlatPat
内容の詳細は後日コメントしますが、sgRNAを用いるCRISPR-CAS9システムについての大半をカバー特許となります。
大まかなクレームの種類は以下のとおり。
・標的DNAの修飾方法
・組成物
・単一分子DNA標的化RNA、または前記単一分子DNA標的化RNAをコードするDNAポリヌクレオチド(sgRNAまたはsgRNAをコードするDNA)
・キット
・遺伝子改変された真核生物細胞
特筆すべきは、sgRNA自体をカバーする特許が成立したことでしょう。
sgRNA自体をカバーする特許があれば、例えば、下記のようなsgRNAを利用する試薬・キット等は基本的にこの特許にカバーできます。
CRISPR/Cas9 プラスミド システム|クロンテック製品情報|タカラバイオ株式会社
ということで、この分野で事業を実施する上でかなり重要な特許が成立しました。
基礎出願の包袋閲覧(特許)
気がつけば年末です。
師走とはいいますが、12月週3-4ペースで出張しており、中々きついもの。
仕事は増える一方、処理する時間はない…
年度末までこんなものでしょう。
本年最後の投稿は、基礎出願の包袋の閲覧について。
係争事件になると基礎出願の包袋の確認が必要となることがあります。
ただし、未公開出願は、出願人以外が閲覧することは原則できません(特許法第186条第1号)。
この規定には例外があり、基礎出願の包袋は、基礎出願に対する優先権を主張する出願が公開された場合、閲覧請求が可能となります(方式審査便覧58.20)。
基礎出願および優先権主張出願がともに国内出願である場合は、便覧どおりの取扱いとなりますが、優先権主張出願が国際出願(日本語でのPCT出願)である場合、国際公開後に基礎出願の包袋を閲覧できるのでしょうか?
おそらく可能と推定されますが、600円払ってだめだともったいないので、念のため特許庁に確認してみました。
なお、基礎出願の明細書等は、WIPOのデータベースから該当する国際出願の優先権証明書等により確認できます。
日本語でのPCT出願の場合、国際公開後であれば、通常の閲覧請求により基礎出願の包袋は閲覧できるとのことでした。
この場合、通常どおり、基礎出願の出願番号を記載して閲覧請求をすれば、特許庁側で優先権主張出願の公開の有無を自動的に判別するため、優先権主張出願の出願番号または国際公開番号を【その他】欄等で記載する必要は無いとのことです。
ということで、日本語の出願同士で有る場合、基礎出願(国内)→優先権主張出願(PCT)であっても、優先権主張出願が公開されれば、基礎出願は閲覧できるようです。